本實驗室在不同的靈芝屬菌株中發現,許多相異於LZ-8的靈芝免疫調節蛋白質,這意謂著未來將有LZ-9、LZ-10……等許多靈芝免疫調節蛋白質的出現,而且它們的生理功能甚至可能更優於LZ-8!
文/許瑞祥
◎本文原載於2004年10月《健康靈芝》第26期 20~26頁
由日本人發現的 LZ-8 已被證實具有抑制自體免疫性第一型糖尿病之發生、延緩異體移植所產生的排斥效應,以及調整過敏體質等多種免疫調節的生理活性。其構造與人類免疫球蛋白相似,對人類紅血球也不發生任何凝集反應,很適合應用在醫療用途上。
雖然 LZ-8 之部分胺基酸序列已經被多國專利所保護,然而臺灣大學微生物暨生物化學研究所卻在不同的靈芝屬菌株中發現,許多相異於 LZ-8 的靈芝免疫調節蛋白質,在這兩段受專利保護的區間裡胺基酸序列仍有所差異。
這不啻意味著未來將有 LZ-9、LZ-10……等等許多靈芝免疫調節蛋白質的出現,其生理功能甚至可能更優於目前已經被專利的 LZ-8!
靈芝自古以來為我國吉祥如意的象徵,同時亦是滋補強壯、扶正固本的珍貴藥材。根據中國著名藥學典籍《神農本草經》的記載,靈芝被列為「上品」,意指養生之藥,長期服用可調整體質且無副作用。
1970 年代中國所發表的臨床報告指出,靈芝製劑對於慢性支氣管炎、哮喘、冠心病、心絞痛、高脂血症、神經衰弱、肝炎、白血球減少症等有很好的療效。此結果證實了古籍所述對靈芝的藥用價值,也引發現代醫藥學界對靈芝化學組成及藥理研究的高度興趣。
經過三十年的藥理研究結果確認,靈芝的萃取物中具有鎮靜、鎮痛、鎮咳、強心、保肝、降血壓、降血脂、降血糖、降膽固醇、抗過敏、抗發炎、抗腫瘤、抗病毒、抗氧化與免疫調節功能等活性成分,而廣受各國研究人員的重視,成為延遲老化、預防慢性疾病的寄託。
靈芝是屬於真菌界(Myceteae)、無鞭毛菌門(Amastigomycota)、擔子菌綱(Basidiomycetes)、無蕈褶目(Aphyllophorales)、多孔菌科(Polyporaceae)中的靈芝屬(Ganoderma),而靈芝屬的主要特徵在於具有雙層細胞壁的擔孢子。
目前靈芝屬在文獻中雖然有 200 種左右,但在藥理和臨床的研究中只有靈芝(Ganoderma lucidum)、松杉靈芝(G. tsugae)、薄樹靈芝(G. capense)、狹長孢靈芝(G. boninense)、無柄靈芝(G. resinaceum)等紅色的靈芝和中國紫芝(G. sinense)、新日本靈芝(G. neo-japonicum)等紫色靈芝,以及樹舌靈芝(G. applanatum)等少數特定的靈芝被研究與利用。
在靈芝的藥理研究中,抗癌活性是最早被發現的。其中,靈芝多糖體被認為是抗癌活性的主要成分,其他尚有三萜類和小分子蛋白質等活性物質。
1971 年 Sasaki 等人發表樹舌靈芝(G. applanatum)的多糖體具抗腫瘤活性,使得多糖體成為靈芝第一項被證實的活性成分(Sasaki, 1971)。目前已經了解其作用機制並非直接殺死或抑制癌細胞,而是經由提高免疫力來間接表現其抗癌活性:活化 T 細胞,並增強自然殺手細胞的能力(Lei and Lin, 1991)。
此外,對於單核的巨噬細胞亦可增強其吞噬能力,並促進抑制腫瘤生長的細胞激素,如介白素(IL-2、IL-4)、干擾素(IFN-γ)、腫瘤壞死因子(TNF-α)等的合成與釋放(Lieu et al., 1992)。經由強化自然殺手細胞和巨噬細胞,直接攻擊不正常的腫瘤細胞,達到防癌、抗癌之效果。
這種藉由提供生理訊號來啟動原本具有的能力,相當符合傳統中國醫學所謂「扶正固本」的觀念。此作用亦類似於西方醫學所謂「生物反應修飾劑」(biological response modifier, BRM)的概念,經由增強或調節機體的免疫功能,減輕致病因素對人體的傷害,進而提高人體抗病能力,達到治病、防病的目的(Mizuno et al, 1995)。
除了多糖體外,1982年 Kubota 等從靈芝(G. lucidum)的子實體中萃取出特殊的三萜類化合物,命名為靈芝酸 A、B(ganoderic acid A、B),迄今至少有 119 種新的三萜類化合物自靈芝的子實體、菌絲體和擔孢子中被發現。
這些三萜類除了構成靈芝屬苦味的成分外,目前所知其藥理研究結果包括:毒殺癌細胞株、抗 HIV 病毒、抗氧化、抗過敏、抗高血壓、保肝等作用(Kim and Kim, 1999)。
靈芝的另一種活性物質,免疫調節蛋白質,於 1989 年由日本學者 Kino 等人自 G. lucidum 菌絲體中分離出來,命名為 LZ-8(Ling Zhi-8)。LZ-8 由 110 個胺基酸所組成(圖一),分子量為 12,420Da,其構造與人類免疫球蛋白重鏈區之可變區域的胺基酸序列及二級結構有某程度的相似性(Tanaka, 1989)。
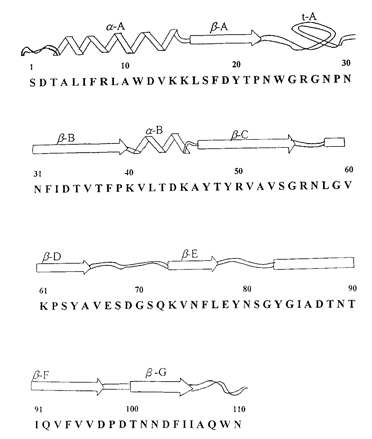
原態的 LZ-8 是以同源雙體(homodimmer)的形式存在,具有促進淋巴球增殖、抑制系統性過敏反應(systemic anaphylaxis reaction)和局部過敏反應(arthus reaction)的作用。此外,LZ-8 對於綿羊紅血球會產生凝集作用,對人類紅血球卻不發生任何凝集反應(Kino, 1989),這顯示 LZ-8 在人類醫藥用途上有其開發應用之潛力。
LZ-8 與外源凝集素(lectin)一樣,具有凝集細胞和促進淋巴球增殖的能力。由於外源凝集素對醣類具有專一性結合的能力,故又稱「親醣蛋白」。這種對醣類專一性結合的特性,使其具有結合細胞表面特定醣基,進而刺激細胞引發後續免疫反應之能力。
在 LZ-8 被發表的同時,支持研究 LZ-8 的日本明治集團同時在日本、歐洲和美國申請專利。日本方面分別於 1990 年(JP2032026)、1991 年(JP3172184)和 1993 年(JP5068561)通過 LZ-8 作為抗愛滋藥劑與核酸序列之專利。歐洲和美國則於 1994 年(EP0288959B1、US5334704)通過 LZ-8 蛋白質特性和作為免疫抑制藥劑之專利。
除此之外,歐美的專利內容還針對 LZ-8 部分序列加以保護:只要有任一醣蛋白之蛋白質序列中同時具有 -Leu-Ala-Trp-Asp-Val-Lys- 和 -Asn-Leu-Gly-Val-Lys-Pro-Ser-Tyr-Ala-Val- 等胺基酸組成,便侵犯到LZ-8的專利範圍。因此,其他各國對靈芝免疫調節蛋白有興趣的研究人員只好轉移研究對象,嘗試從各種菇類中搜尋是否有類似的蛋白質存在,如金針菇(Ko, 1995)與草菇(Hsu, 1997)。
自 1989 年 Kino 發現 LZ-8 可刺激鼠科脾臟細胞增殖,以及避免局部性和系統性過敏反應,後續更有研究指出 LZ-8 可以有效抑制非肥胖型糖尿病鼠(Nonobese diabetic, NOD)的自體免疫性第一型糖尿病之發生(Kino, 1990)。此外,LZ-8 在胰臟異體移植方面可以顯著延緩發生排斥的時間。
相較於其他免疫調節藥物(immunomodulatory drug),如 CsA(cyclosporin A,來自真菌具有免疫抑制作用的胜肽)和 FK506(tacrolimus,由土壤真菌所分泌具有免疫抑制作用的抗生素)對於胰臟皆有毒害的危險,但 LZ-8 對於胰島則沒有發現有任何毒害作用(ven der Hem, 1995)。以上結果皆顯示 LZ-8 可成為極具潛力的免疫調節藥物。
LZ-8 不論在活體外或是活體內的實驗,都顯現出其免疫調節活性,但其確切作用機制卻仍舊不明朗。Kino 等於 1991年發現LZ-8可抑制老鼠抗體的產生,推測 LZ-8 乃藉由阻斷抗體的產生而達到抑制系統性及局部性過敏反應(Kino, 1991)。此後,更發現 LZ-8 是透過調控細胞表面附著的分子來達到調節細胞間的交互作用(Miyasaka, 1992),而此交互作用正是自體免疫疾病患者所缺乏。
自 LZ-8 序列發表後,臺大醫學院生化所也成功自松杉靈芝(G. tsugae)菌絲體中純化出分子量約13 kD的免疫調節蛋白,命名為 FIP-gts(Fungal immunomodulatory protein-gts)。經胺基酸序列分析,發現其序列與LZ-8完全相同。
LZ-8 不但可以促進人類周邊淋巴球細胞(Human peripheral lymphocytes)和小鼠脾臟細胞增生,由細胞攝入 3H-thymidine 之量對蛋白質濃度作圖,可得一鐘形圖:在濃度為 5 μg/ml 時,對人類周邊淋巴球細胞可達最高之增殖作用。利用 RT-PCR 方法也證實 LZ-8 可促進細胞激素,如介白素(IL-2、IL-4)、干擾素(IFN-γ)和腫瘤壞死因子(TNF-α)之表現。
除此之外,在一些非靈芝屬的菇類中也可純化出分子量約 13 kD 的免疫調節蛋白,例如:金針菇的 FIP-fve(Ko, 1995)和草菇的 FIP-vvo(Hsu, 1997)。經胺基酸序列分析結果顯示,LZ-8、FIP-fve 和 FIP-vvo共有 51 個相同胺基酸(圖二),且均含有與人類免疫球蛋白重鏈的可變區域相當之相似性。因此可推論由靈芝、金針菇和草菇所純化出之免疫調節蛋白質,在演化上可能都是來自同一起源。

為進一步探討免疫調節蛋白質的作用機制,將 LZ-8 利用遺傳工程技術,藉由大腸桿菌細胞大量表現,並配合分子生物之刪除突變及定點突變技術,可以得到許多不同的突變蛋白質,用以探討其他生理活性與此蛋白質之活性區位及作用機制。
由實驗結果顯示,若將胺基端刪除 13 個胺基酸,突變蛋白質除了喪失形成同源雙體和凝集細胞之能力外,同時也無法促進細胞激素如介白素(IL-2、IL-4)、干擾素(IFN-γ)、腫瘤壞死因子(TNF-α)之分泌(Lin, 1997)。
綜合上述結果證實,免疫調節蛋白(LZ-8)是藉由胺基端的胺基酸形成雙體構形結合到淋巴球 T 細胞上,造成細胞凝集,使得 T 細胞活化而啟動一連串之訊息傳遞,並促進各種細胞激素的分泌來達成免疫調節之功能。
近年來台灣衛生環境較過去進步許多,但是過敏性患者卻日益增多,目前較合理的解釋是「衛生假說(hygiene hypothesis)」,也就是「在越清潔的環境中,幼年時期受到的感染越少,則可能導致過敏性疾病罹患率的增加」(Zuany-Amorim et al., 2002)。以免疫學理論而言,是由兩種表現不同細胞激素的功能性 T 細胞(T helper 1, T helper 2)之間的平衡關係來解釋。
目前認為,早期的細菌或病毒感染會使體內的免疫系統偏向增強 Th1 細胞,進而抵銷 Th2 細胞的過敏反應;反之,若細菌感染的機會降低,則造成體內的 Th1 反應較弱,而產生過度的 Th2 反應,以致於過敏反應的增加(Yazdanbakhsh et al., 2002)。有鑑於此,若是能調節體內的免疫反應使其偏向於 Th1,或許能夠治療甚至是預防過敏性疾病的發生。
由先前的研究發現,LZ-8 可促進細胞激素如介白素(IL-2、IL-4)、干擾素(IFN-γ)、腫瘤壞死因子(TNF-α)之分泌(Lin, 1997; Haak-Frendscho, 1993)。其中,IL-2 和 IFN-γ屬於 Th1 細胞產生之細胞激素;IL-4 則隸屬 Th2 細胞。
但是更進一步研究發現,隨著 FIP-gts 作用時間拉長,IL-4 的產量卻逐漸下降,而 IFN-γ 仍維持高含量。顯示 FIP-gts 誘導 IL-4 之產生似乎屬於較前期且短暫,培養時間一久,取而代之的是細胞間開始大量產生的 IFN-γ。因此 LZ-8 刺激產生的細胞激素應較偏向 Th1 細胞之活化。
LZ-8 具有促進 Th1 細胞產生細胞激素 IFN-γ 大量產生而與 Th2 細胞反應發生拮抗的能力,使其成為調整過敏體質的最有潛力的藥物之一。
經中山醫學院毒理所實驗室研究結果顯示,以 LZ-8 餵食塵蟎致敏小鼠兩週後發現,可使致敏後小鼠增高之噬鹼性白血球比例降回至正常值範圍。顯示此種靈芝免疫調節蛋白質(LZ-8)的免疫調節功能可以修正體內過度的免疫反應,用於預防或治療目前罹患率日趨增加的過敏性疾病。
換言之,日後對於具有過敏體質的患者而言,若能長期使用靈芝免疫調節蛋白質(如 LZ-8),應該可以調整過敏體質、調整體內過度的免疫反應,達到治療的效果;對於一般民眾而言,若平日能適量攝取,則可以避免體內的過敏反應過度被刺激,達到預防的效果。
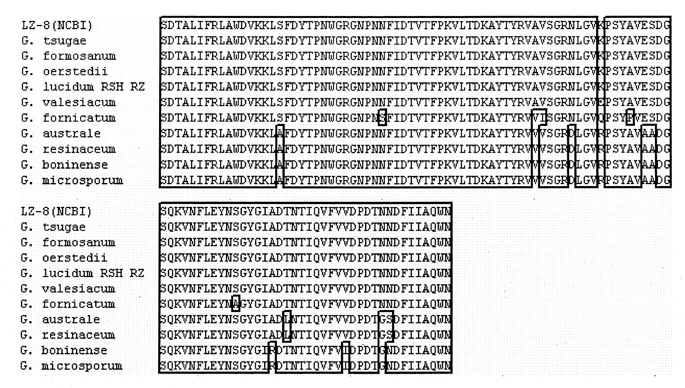
為瞭解其他靈芝屬菌種中是否也存在著此類免疫調節蛋白質基因,我們將數十種不同靈芝菌種的基因抽出後,利用聚合擴增技術來篩選是否存在有此免疫調節蛋白質之相似基因。
在將近 50 株不同菌種的靈芝中,均可得到片段大小相同的基因產物,選定其中 10 種菌種進行定序結果(圖三),發現共有 4 株菌株具有與 LZ-8 完全相同之胺基酸序列,其餘菌株則分別含有 1~9 個不同的胺基酸序列,此結果顯示免疫調節蛋白質 LZ-8 是靈芝家族成員的基本配備。
除此之外,利用相同方法檢驗其他真菌,如巴西蘑菇、香菇、洋菇、秀珍菇,甚至是酵母菌,同樣發現有大小相似的基因產物存在。顯示此類免疫調節蛋白質之基因可能是廣泛存在於真菌界的物種當中,至於此類基因產物在真菌細胞生理作用中扮演何種角色,則必須再更深入探討。
LZ-8 之部分胺基酸序列雖然已經被多國專利所保護(-Leu-Ala-Trp-Asp-Val-Lys- 和 -Asn-Leu-Gly-Val-Lys-Pro-Ser-Tyr-Ala-Val-),但是本實驗室在不同的靈芝屬菌株中發現,許多相異於LZ-8的靈芝免疫調節蛋白質在這兩段受專利保護的區間裡胺基酸序列仍有所差異。
這不啻意謂著未來將有 LZ-9、LZ-10……等等許多靈芝免疫調節蛋白質的出現,而且這些靈芝免疫調節蛋白的生理功能(抑制自體免疫性第一型糖尿病之發生、延緩異體移植所產生的排斥效應,以及調整過敏體質等),甚至可能更優於目前已經被專利的 LZ-8!
雖然各種靈芝屬來源的免疫調節蛋白質其所具有的胺基酸序列相似性很高,但是蛋白質結構往往會因為一、兩個關鍵性胺基酸的突變而發生劇烈改變,導致此蛋白質活性發生變化。因此,其他相異於 LZ-8 的各種靈芝屬來源的免疫調節蛋白質,其功效也可能會異於 LZ-8。
為探討不同靈芝屬的免疫調節蛋白質間,其生理活性是否有所不同,本實驗室已成功將不同序列的靈芝免疫調節蛋白質基因,大量表現於大腸桿菌、乳酸桿菌、酵母菌和米麴菌中,後續並將進行此重組蛋白質的生理活性測試,期望能從中篩選出更具療效的免疫調節蛋白質,為台灣的靈芝生技產業提供另外一個舞台。
1. Haak-Frendscho M, Kino K, Sone T, Jardieu P. 1993. Ling Zhi-8: A novel T cell mitogen induces cytokine production and upregulation of ICAM-1 expression. Cell Immunol. 150: 101-13.
2. Hsu HC, Hsu CI, et al. 1997. Fip-vvo, a new fungal immunomodulatory protein isolated from Volvariella volvacea. Biochem. J. 323 (Pt 2) : 557-65.
3. Kim HW, Kim BK. 1999. Biomedicinal triterpenoids of Ganoderma lucidum (Curt.:Fr.) P. Karst. (Aphyllophoromycetideae). Intl. J. Med. Mush. 1 : 121-38.
4. Kino K, Mizumoto K,et al. 1990. An immunomodulating protein, Ling (Zhi-8) prevents insulitis in non-obese diabetic mice. Diabetologia 33: 713-8.
5. Kino K, Sone T, et al. 1991. Immunomodulator,LZ-8, prevents antibody production in mice. Int J Immunopharmacol. 13(8): 1109-15.
6. Kino K, Yamashita A, et al. 1989. Isolation and characterization of a new immunomodulatory protein, Ling Zhi-8 (LZ-8), from Ganoderma lucidum. J. Biol. Chem. 264 (1): 472-8.
7. Ko JL, Hsu CI, et al. 1995. A new fungal immunomodulatory protein, FIP-fve isolated from the edible mushroom, Flammulina velutipes and its complete amino acid sequence. Eur. J. Biochem. 228: 244-9.
8. Kubota T, Asaka Y, et al. 1982. Structures of ganoderic acids A and B, two new lanostane type bitter triterpenes from Ganoderma lucidum (Fr.) Karst. Helv. Chim. Acta. 65: 611-9.
9. Lei LS, Lin ZB. 1991. Effect of Ganoderma polysaccharides on the activity of DNA polymerase α in spleen cells stimulated by alloantigens in mice in vitro. J. Beijing Medical University, 23(4): 329-33.
10. Lieu CW, Lee SS, et al. 1992. The effect of Ganoderma lucidium on induction of differentiation in leukemic U937 cells. Anticancer Research, 12 (4): 1211-5.
11. Lin WH, Hung CH, et al. 1997. Dimerization of the N-terminal amphipathic alpha-helix domain of the fungal immunomodulatory protein from Ganoderma tsugae (Fip-gts) defined by a yeast two-hybrid system and site-directed mutagenesis. J. Biol. Chem. 272 (32) : 20044-8.
12. Miyasaka N, Inoue H, et al. 1992. An immunomodulatory protein, Ling Zhi-8, facilitates cellular interaction through modulation of adhesion molecules. Biochem. Biophys. Res. Commun. 186: 385-390.
13. Mizuno T, Sakai T, et al. 1995. Health foods and medicinal usages of mushrooms. Food Reviews International, 11(1) : 69-81.
14. Sasaki T, Arai Y, et al. 1971. Antitumor polysaccharides from some polyporaceae, Ganoderma applanatum (Pers.) Pat and Phellinus linteus (Berk. et Curt) Aoshima. Chem. Pharm. Bull. (Tokyo) 19(4): 821-6.
15. Tanaka S, Ko K, et al. 1989. Complete amino acid sequence of an immunomodulatory protein, Ling Zhi-8 (LZ-8). An immunomodulator from a fungus, Ganoderma lucidum, having similarity to immunoglobulin variable regions. J. Biol. Chem. 264 (28): 16372-7.
16. Van der Hem LG, van der Vliet JA, et al. 1995. Ling Zhi-8: studies of a new immunomodulating agent. Transplantation. 60(5): 438-43.
17. Yazdanbakhsh M, Kremsner PG, et al. 2002. Allergy, parasites, and the hygiene hypothesis. Science 296 (5567) : 490-4.
18. Zuany-Amorim C, Sawicka E, et al. 2002. Suppression of airway eosinophilia by killed Mycobacterium vaccae-induced allergen-specific regulatory T-cells. Nat. Med. 8 (6): 625-9.
COPYRIGHTS © Ganodermanews SINCE By 2015 ALL RIGHT RESERVED.
靈芝新聞網 版權所有 | 本網站內容作者享有其著作權,禁止侵害,違者必究
Powered by
ganodermanews.com