靈芝在生技領域研發的新趨勢
- 詳細內容
- 分類:臺灣大學 許瑞祥教授
- 建立於 2015-06-24, 週三 00:56
- 點擊數:13993
靈芝已進入全面開發應用時候,不但菌體要完整的充分利用,靈芝來源的特殊基因,包括可以表現多種療效的免疫調節蛋白基因,以及可以應用在環境保護和生物復育的漆氧化酶基因,將開啟另一波功能性基因體與蛋白質體研究的熱潮。以靈芝為表達系統作為生產特定蛋白質的分子農場,將帶動靈芝產業與市場無限提升的可能。
文/許瑞祥
◎本文原載於 2005年《農業生技產業季刊》第3期 37~44頁
一、靈芝製品發展現況
靈芝在中華文化裡,無論從稗官野史中起死回生的仙草,到歷代官方文書中加官晉爵的太上之藥,皆顯示中華民族與靈芝深厚的淵源。從公元前一世紀的《神農本草經》到明朝李時珍的《本草綱目》,一千六百年間不斷修正補充有關靈芝的分類、氣味、藥性和主治功效等的論述,奠定了靈芝是扶正固本、滋補強壯珍貴藥材的理論基礎(許,1993)。
1950 年代開始靈芝的大量人工栽培後,為靈芝的科研及產品開發提供了充足的原料。1970 年代中國大陸地區所發表臨床報告指出靈芝製劑對慢性支氣管炎、哮喘、冠心病、心絞痛、高脂血症、神經衰弱、肝炎、白血球減少症等有很好的療效,此結果證實了古籍所述對靈芝的藥用價值,也引發現代醫藥學界對靈芝進行化學組成與藥理研究的高度興趣。
經過三十年的藥理研究結果確認靈芝的萃取物中,具有鎮靜、鎮痛、鎮咳、強心、保肝、降血壓、降血脂、降血糖、降膽固醇、抗過敏、抗發炎、抗腫瘤、抗病毒、抗氧化與免疫調節功能等的活性成分,而廣受各國的重視(許,1993;林,2001)。根據 2005 年張樹庭教授的估計,全球靈芝產品的年產值超過25 億美元,市場主要集中在中國、日本、韓國、台灣等國家地區(Chang, 2005)。
1980 年代台灣開始靈芝子實體的大量栽培,除了供應日本所需的原料外,也帶動了國內靈芝研究的風氣,1987 年國科會主導推動靈芝大型研究計畫後,不但引爆了台灣靈芝研究的熱潮,也開創了靈芝市場在台灣的黃金歲月,1990 年代,靈芝相關產品的營業額估計已達新台幣 60 億以上,成為當時健康食品的代表。1999 年的健康食品管理法公佈實施後,健康食品由一般名詞成為法定名詞後,結束了昔日百家爭鳴的局面,為台灣靈芝市場提供可以標示功效的健康食品,也為業界提供產業升級的空間。
中國是全球靈芝產品最多元的地區,除了藥品級的針劑、錠劑、膠囊、蜜丸和糖漿等,與保健食品級的膠囊、口服液和沖劑外,亦有食品或化妝品添加靈芝者。2000 年版的《中華人民共和國藥典》中,收載了靈芝作為法定中藥材。中國衛生部也批准靈芝作為食品新資源,從中國法律的立場確認靈芝為藥食兼用的地位(林,2001)。
二、靈芝菌體的開發應用
(一)靈芝活性成分研究成果
1. 多糖體
1971 年 Sasaki 等人發表樹舌靈芝(G. applanatum)的多糖體具抗腫瘤活性的論文後,使得多糖體成為靈芝第一項被證實的活性成份(Sasaki et al, 1971)。
在靈芝的藥理研究中,抗癌活性是最早被發現的。而靈芝多糖體被認為是抗癌活性的主要成份,但其作用並非是直接殺死或抑制癌細胞。目前已知靈芝多糖體是經由提高免疫力來間接表現其抗癌活性。靈芝多糖體對免疫細胞具有廣泛的作用,如促進白細胞素-2(IL-2,也稱介白素 2)分泌而增加 T 細胞數目及功能(Lai and Lin, 1992),增強 T 細胞多聚酶α活性促進其 DNA 合成,而增殖 T 細胞,並可增強自然殺手細胞的能力(Lai and Lin, 1991)。
靈芝多糖體對於單核球的巨噬細胞作用,會使其表現出生吞噬能力增強、溶酶體活性增高及促進產生抑制腫瘤生長的細胞激素如 IL-1、IL-2、IL-6、INF-α、INF-γ 等的合成與釋放(Lieu et al, 1992)。並經由強化自然殺手細胞和巨噬細胞直接攻擊不正常的腫瘤細胞,達到防癌、抗癌的效果。因此靈芝多糖體除了用於抗癌作用外,對於各種免疫缺陷疾病,如老年人的自然免疫衰退或後天免疫不全症(AIDS)應有積極的應用價值。
雖然靈芝多糖體的效用明確,但由於其分子量相當大,通常在數萬到百萬之間,如此巨大的物質如何進入細胞中參與一連串複雜的免疫反應,一直是想了解其作用機制的前提。但是不同物種來源的靈芝多糖體是否皆相同呢?此類具有β(1-3)主鏈和β(1-6)支鏈的葡萄糖聚合物,原本被認為是一般高等真菌細胞壁的基本組成,經熱水或鹼性溶液萃取後再經酒精沈澱而得。
根據日本水野卓教授多年的分析結果顯示常見的三種靈芝 G. applanatum、G. lucidum、G. tsugae 其萃取所得的多糖體和其抗癌的有效成分間是不相同的。以樹舌靈芝(G. applanatum)的多糖體而言,其分子量在百萬以上,且幾乎為純的葡萄糖聚合物。但在 G. lucidum 和 G. tsugae 來源的多糖體中則含有不同百分比的蛋白質,顯示其為糖蛋白的聚合物,且各種組成間的抗癌活性亦不相同。此結果顯示,要比較靈芝多糖體的效果時,首先必須確認靈芝種源的差異性(Wang et al,1993)。
靈芝多糖體的抗腫瘤機制經榮總王聲遠教授發表從細胞激素的證據,說明靈芝多糖體能抑制腫瘤細胞的增殖作用是透過免疫系統中的巨噬細胞和 T 淋巴細胞產生的 TNF-α 與 IFN-γ 協同作用的結果(Wang et al, 1997),最近的研究顯示不同子實體來源的靈芝多糖體,如 F3、GLPS、PS-G 等,活化免疫細胞如巨噬細胞或突觸細胞產生介白素-1(IL-1)等的胞內訊息,是經過細胞表面 TLR4(Toll-like receptor-4)受體向內傳遞(Hsu et al, 2004;Lin et al, 2005)。
2. 三萜類
1982 年,Kubota 等從靈芝 G. lucidum 的子實體中萃取而得特殊的三萜類化合物命名為靈芝酸 A、B(ganoderic acid A、B)後(Kobota et al, 1982),迄今至少有 119 種新的三萜類化合物自靈芝的子實體、菌絲體和擔孢子中被發現。1999 年 Kim等依其結構分為十種類型。靈芝三萜類的藥理研究結果,包括毒殺癌細胞株、抗 HIV 病毒、抗氧化、抗過敏、抗高血壓、保肝等作用(Kim and Kim, 1999)。
由此可知豐富的三萜類化合物提供了靈芝多樣的生理活性,但一百多種的三萜類化合物並非穩定的存在同一物種中,而會隨著菌種、栽培方式、採收時期與萃取程序等的不同,改變其中三萜類的組成與含量。
三、靈芝基因的開發研究
(一) 免疫調節蛋白質基因的研究進展
靈芝的另一種活性物質,免疫調節蛋白,於 1989 年由日本學者 Kino 等人自 G. lucidum 菌絲體中分離出來,命名為 LZ-8(Ling Zhi-8)。LZ-8 由110 個胺基酸所組成(圖一),分子量為 12,420 Da,並且與免疫球蛋白重鏈區之可變區域的胺基酸序列及二級結構有某程度的相似性(Tanaka, 1989)。
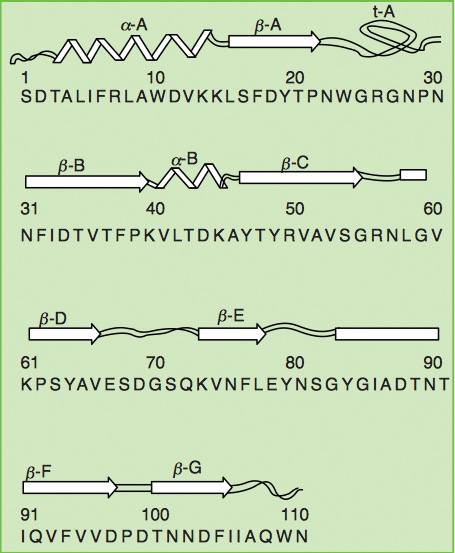
圖一 LZ-8 之胺基酸序列與二級結構圖(Lin, 1997)
LZ-8 原態是以同源雙體(homodimmer)的形式存在,具有促進淋巴球增殖以及抑制系統性過敏反應(systemic anaphylaxis reaction)和局部過敏反應(arthus reaction)的作用。此外,LZ-8 對於綿羊紅血球會產生凝集作用,對人類紅血球卻不發生任何凝集反應(Kino, 1989),這顯示 LZ-8 在人體醫學上有其應用之潛力。
自 1989 年 Kino 發現 LZ-8 可刺激鼠科脾臟細胞增殖,以及避免局部性和系統性過敏反應,後續更有研究指出 LZ-8 可以有效抑制非肥胖性糖尿病鼠(nonobese diabetic, NOD)的自體免疫性第一型糖尿病之發生(Kino, 1990)。
此外,LZ-8 在胰臟異體移植方面可以顯著延緩排斥的時間。相較於其他免疫調節藥物(immunomodulatory drug),如 CsA(cyclosporin A,來自真菌具有免疫抑制作用的胜肽)和 FK506(tacrolimus,由土壤真菌所分泌具有免疫抑制作用的抗生素)對於胰臟皆有毒害的危險,但 LZ-8 對於胰島細胞則沒有發現有任何毒害作用(ven der Hem, 1995)。
自 LZ-8 序列發表後,台大醫學院生化所也成功自松杉靈芝(G. tsugae)菌絲體中純化出分子量約 13 kD 的免疫調節蛋白,命名為 FIP-gts(fungal immunomodulatory protein-gts)。經胺基酸序列分析,發現其序列與 LZ-8 完全相同。 LZ-8 不但可以促進人類周邊淋巴球細胞(human peripheral lymphocytes)和小鼠脾臟細胞增生,由細胞攝入 3H-thymidine 之量對蛋白質濃度作圖,可得一鐘形圖:在濃度為 5 μg/ml 時,對人類周邊淋巴球細胞可達最高之增殖作用。利用 RT-PCR 方法也可證實 LZ-8 可促進細胞激素如:間白細胞素(IL-2、IL-4)、干擾素(IFN-γ)、腫瘤壞死因子(TNF-α)之表現(林,1997)。
中山醫學大學毒理學研究所研究結果顯示,以 FIP-gts 餵食塵蟎致敏小鼠兩週後發現,可使致敏後小鼠增高之噬鹼性白血球比例,降回至正常值範圍。顯示 LZ-8 的免疫調節功能可以輔正體內過度的免疫反應,加以預防或治療目前罹患率日趨增加的過敏性疾病(黃,2003)。
除此之外,在一些非靈芝屬的菇類中也可純化出分子量約 13 kD 的免疫調節蛋白,例如:金針菇的 FIP-fve (Ko et al., 1995)和草菇的 FIP-vvo (Hsu et al., 1997)。經胺基酸序列分析,LZ-8、FIP-fve 和 FIP-vvo 共有 51 個相同胺基酸(圖二),且均含有與免疫球蛋白重鏈的可變區域相當之相似性。因此可推論,由靈芝、金針菇和草菇所純化出之免疫調節蛋白,在演化上可能都是來自同一祖先。

圖二 FIP-gts 、FIP-fve 及 FIP-vvo 胺基酸序列比較(Lin et al. 1997)
2005 年本研究室完成針對靈芝屬 G. applanatum、G. boninense、G. formosamun、G. fornicatum、G. lucidum、G. microsporum、G. neo- japonicum、G. oerstedii、G. resinaceum、G. sinense、G. tropicum、G. tsugae、G. valesiacum、G. weberianum 等菌株進行聚合酶連鎖反應分析結果,將近 50 株不同菌種的靈芝中,均可得到片段大小相同的基因產物,顯示免疫調節蛋白 LZ-8 相似基因普遍存在於靈芝屬菌株中,但是這些菌株所得之基因序列並非皆與 lz-8 相同,部分菌株更發現同時具有兩種以上的 LZ-8 相似基因。
此外採用 genome walking 技術於 G. microsporum 及 G. fornicatum 分別選殖出三條靈芝屬免疫調節蛋白新基因 gmi、gfo-1 與gfo-2 。將 lz-8、gmi 及 gfo-1 等基因轉殖入 Pichia pastoris KM71 以甲醇誘導方式進行胞外表現,可得重組蛋白 rePLZ、reGMI 及 reGFO-1 ,經 MALDI- TOF 質譜分析結果顯示,重組蛋白並無任何醣基化現象,最後目標蛋白產量平均可達 300 mg/L。
重組蛋白進行免疫調節活性測定,皆可刺激 BALB/c 老鼠骨髓之樹突細胞(dendritic cells, DCs)分泌 IL-12 ,也可刺激老鼠巨噬細胞株 J774A.1 分泌 TNF-α 及刺激人類 T 細胞株 Jurkat cells 分泌 IL-2 ,其中 reGMI 於 5 μg/mL 下可刺激 DCs 分泌 IL-12 的量為相同濃度 rePLZ 之六倍(林,2005)。
除了將不同的靈芝免疫調節蛋白質基因大量表現於 Pichia pastoris 外,亦已將表現於大腸桿菌、乳酸菌、糖化酵母菌以及麴菌中,後續進行的生理活性測試,期望能篩選出容易生產、更具療效的新型免疫調節蛋白。

圖三 LZ-8 與十種靈芝屬免疫調節蛋白部分胺基酸序列之比對(林,2005)
(二) 漆氧化酶基因
纖維素、半纖維素、木質素是自然界中存量最多的大分子物質,其中木質素由於結構複雜最難以分解。已知有三種酵素具有分解木質素之功能分別為漆氧化酶(laccase, 1.10.3.2)、含錳過氧化酶(manganese peroxidase, 1.11.1.13)和木質素氧化酶(lignin peroxidase, 1.11.1.14)。
其中的漆氧化酶為積極開發的工業用酵素之一,在製酒過程,漆氧化酶可作為澄清劑,幫助除去白葡萄酒原液中的酚類物質(Servili et al., 2000)。在紙漿工業上,漆氧化酶用於提升木質素的分解效率(Leonowicz et al., 2001)。在工業廢水處理中漆氧化酶能有效分解多種染劑(Abadulla et al., 2000)。
在生物復育上,漆氧化酶能夠分解環境中多種苯環類的有毒物質(Mougin et al., 2000)。另有文獻指出將漆氧化酶基因轉殖到 S. cerevisiae 中,可以增加 S. cerevisiae對於木質纖維水解發酵液中酚類化合物的耐受性,進而提高燃料乙醇的生產率(Larsson et al., 2001)。 Li 和 Steffens 將漆氧化酶基因轉殖到番茄中,轉殖株氧化酚類物質的能力增強,對致病細菌抗性增加(Li and Steffens, 2002)。
有關靈芝屬真菌漆氧化酶之研究,許發表以漆氧化酶同功酵素圖譜進行靈芝屬分類之研究,發現靈芝屬真菌具有多種不同分子量之胞外漆氧化酶,其表現會隨著培養時間的不同而改變(許,1990)。Ko等人發現靈芝單核體(G. lucidum 7071-10)具有三種漆氧化酶同功酶(isozymes),分別進行純化之結果,其中 Galc3 在 pH3-pH10 具有良好的穩定性,具有應用上的潛力(Ko et al., 2001)。在而 D'souza 等以不同的培養條件對靈芝漆氧化酶進行誘導,添加 Veratryl alcohol 能明顯提高胞外漆氧化酶的活性到0.2 U/mL(D'souza et al., 1999)。
本研究室以漆氧化酶基因之保守性序列設計引子,對11株靈芝屬真菌基因進行聚合酶鍊鎖反應,將產物定序,共得到 26 條漆氧化酶基因序列,交互比對結果顯示,靈芝屬真菌各具有兩條以上的漆氧化酶基因,將選殖之序列與相關物種之漆氧化酶基因序列進行演化計算,發現靈芝屬真菌之漆氧化酶可分為三種類型,其中第一類型與第二種類型可分別再分為兩群,序列比對與演化分析顯示,這三類型基因皆有屬於自己不同的非轉譯區(intron),可能是來自獨立演化的結果,其中第三類的漆氧化酶基因在靈芝屬與雲芝屬的分類形成前就已出現,結果如圖四所示。
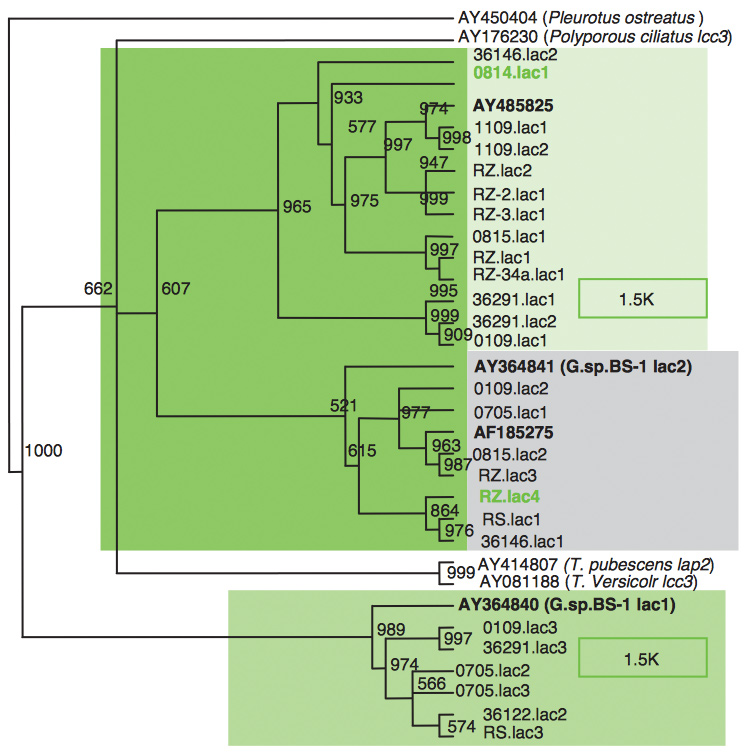
圖四 以漆氧化酶基因之保守性序列設計引子,對11株靈芝屬真菌基因進行聚合酶鍊鎖反應的結果。
自靈芝屬真菌 G. lucidum 、G. tsugae 、G. fornicatum 中,分別選殖出漆氧化酶基因 RZ.lac4 、0814.lac1 、1109.lac1,基因全長依序為 2121 bp、2019 bp、2110bp,皆具有 9 個 intron,其蛋白質各具有 520、521、521 個胺基酸,其中前 21 個胺基酸為 signal peptide ,在保守性 Cysteine 之後第十個胺基酸為 Phenylalanine,顯示三者皆屬具有高還原電位之第三類漆氧化酶。
使用 AOX1 起動子,將所選殖之 1109.lac1 基因轉殖入嗜甲醇酵母 Pichia pastoris KM71 進行異源表現,所得之重組蛋白質具有漆氧化酶活性,最適反應 pH 值為 3.0,最適反應溫度為 65°C 。以 BMMHY 為誘導培養基,以 30°C、0.5% 甲醇誘導七天,所得之胞外上清液活性為 6.6 U/ml ,比活性為 81.7 U/mg 。重組蛋白 re1109.lac1 在55°C 下反應二十四小時仍保有將近 100% 的活性,顯示此異源表達的漆氧化酶具有應用與開發的價值性(戴,2005)。
四、以靈芝作為基因轉殖作物的開發研究
基因轉殖作物是生技產業中相當重要一項研發項目,由 1970 年末至 1995 年間,許多農業生技公司投入基因轉殖植物的研發,依 Global Industry Analysis 統計,2000 年農業生技的市場產值美金 27 億元,其中基因轉殖作物就占其中之美金 21 億元。2004 年市場成長至美金 30 億元,2010 年將成長至美金 60 億元,平均年成長率為 11.2%。
基因轉殖作物的研發大致可分為三階段,1995~2002 年,第一代作物的發展目的是在改變作物特性,例如抗蟲、疾病、耐除草劑、增加產量、加速生長及保鮮等,以降低成本。第二代作物是從 2003 年開始,預期會持續到 2010 年左右,主要目標在增加作物營養價值,如添加β胡蘿蔔素的黃金米及甜甜米、高維生素作物等,以期食用者食用時達到保健目的。
第三代基因轉殖作物發展預計將從 2010 年開始,以基因轉殖作物生產人類醫藥品,稱之為分子農場(Molecular pharming、biopharming 或 pharming)。分子農場指的是利用基因轉殖動植物生產具有醫藥用途或其他具有商業價值之產物,它的目標是提供一個相對安全、大量且便宜的生產方式。其中基因轉殖作物是最具有經濟效益的工業用或醫療用重組蛋白生產方式,目前分子農場的研發目標包含生產特用產物以及開發食用疫苗等,其中以生產特用產物,例如抗體、膜蛋白、人體酵素和開發食用疫苗最具潛力。
除了植物以外,絲狀真菌同樣具有發展潛力。在 1980 年代就開始以麴菌(Aspergillus spp.)從事牛凝乳酶(chymosin)商業生產,人類的免疫球蛋白也可以麴菌生產,以麴菌表現 B 型肝炎病毒抗原的成果更顯示,使用絲狀真菌生產類病毒顆粒(virus-like particle)的可行性。因此絲狀真菌,在分子農場的開發應用具有無限的潛力。
尤其是菇類,除了具備絲狀真菌等微生物之特性外,更是大眾所喜愛的食物,菇類同時具有微生物和植物的優點,不但生長快速、易於操作,相較於植物更容易於密閉的環境中栽培,且基因無法跨種傳遞,大幅降低基因污染風險,因此以菇類表達異源基因系統的開發更有其必要性,除了可取代目前已有的植物系統外,更可開發新應用領域,將分子農場的價值擴大。
以育種的角度而言,傳統育種耗時費力,所以近年來,研究人員希望使用細胞融合、基因重組等新生物技術,改進菇菌的性狀達到育種的目標。開發中的菇菌基因轉殖系統,將導入特定外來基因片段於菇菌細胞染色體內,待外來基因啟動表現後,除了分子育種的應用之外,還可將菇體視為新的表達系統,成為生產特定蛋白質的分子農場。目前利用農桿菌進行洋菇基因轉形主要以荷蘭、英國及美國為主(Burns et al., 2005, Chen et al., 2000),日本以則化學法或電穿孔法進行香菇基因轉形,皆已在菌絲體中成功表現出綠色螢光蛋白(green fluorescent protein)(Hirano et al., 2000)。
靈芝為重要的藥用真菌,已有長期分子層次的研究的基礎,自然成為東方國家發展菇菌基因轉殖系統的優先選擇。中興大學植物所曾經以泛宿主載體 pAN7-1 上的抗 hygromycin B 基因 hph 為篩選標誌建立其基因標的轉形系統。由靈芝單核菌絲製備的原生質體進行聚乙二醇-氯化鈣法轉形後,分析所有不同的轉形株發現其菌落形態、生長速率與抗 hygromycin B 能力不一(1998)。
2001 年中國首先發表以香菇來源的 GPD promoter 啟動以電穿孔法轉形的綠色螢光蛋白基因與其他報導者基因於雙核的靈芝菌絲體中,並在螢光顯微鏡下成功觀察到被激發綠色螢光的轉形株(Sun et al., 2001),靈芝基因的轉形系統與其他食用菇幾乎同時被建立。2004 年韓國發表以 restriction enzyme-mediated integration 的方法進行靈芝單核菌絲基因的轉形,不但可以提高轉形率並且有助於轉形株的篩選(Kim et al., 2004)。
五、結論
千萬年來靈芝一直與人類共存於世,扮演生態環境中分解者的角色。它可分解植物殘體中的纖維素和木質素,促進碳元素循環。雖然在過去百年間,東西方科學家以嚴謹的態度研究靈芝,卻因分類指標不夠明確,忽略了彼此使用材料的差異,因而影響了對靈芝研究結果的整理和評價。生物科技與分子生物技術相結合進行的靈芝系統化研究,已經可以彼此校正過去使用的靈芝菌株間種源的差異性。
現在的靈芝已進入全面開發應用時候,不但菌體要完整的充分利用,靈芝來源的特殊基因將開啟另一波功能性基因體與蛋白質體研究的熱潮。以靈芝為表達系統,作為生產特定蛋白質的分子農場,將帶動靈芝產業與市場無限提升的可能。
參考文獻
1. 林志彬,2001,靈芝的現代研究,北京醫科大學出版社。
2. 林文輝,1966,松杉靈芝免疫調節蛋白的構造與作用機制之研究,碩士論文,台灣大學醫學院生化學研究所。
3. 林采蔆,2005,靈芝屬免疫調節蛋白 GMI 與 GFO-1 基因之選殖與Pichia pastoris 之異源表現,碩士論文,台灣大學微生物與生化學研究所。
4. 許瑞祥,1993,靈芝概論,萬年出版社。
5. 許瑞祥,1990,靈芝屬菌株鑑定系統之研究,博士論文,台灣大學農業化學研究所。
6. 許宗銘,1998,靈芝菌轉形系統之研究,碩士論文,中興大學植物學研究所。
7. 戴意仁,2005,靈芝屬漆氧化酶基因之選殖與異源表現,碩士論文,台灣大學微生物與生化學研究所。
8. 黃玉儒,2003,靈芝免疫調節蛋白的作用機制及其減緩塵蟎致敏之應用,碩士論文,中山醫學大學毒理學研究所。
9. Abadulla E, Tzanov T, Costa S, Robra KH, Cavaco-Paulo A, Gubitz GM. 2000. Decolorization and detoxification of textile dyes with a laccase from Trametes hirsuta. Appl Environ Microbiol. 66(8): 3357-62.
10. Burns C, Gregory KE, Kirby M, Cheung MK, Riquelme M, Elliott TJ, Challen MP, Bailey A, Foster GD. 2005. Efficient GFP expression in the mushrooms Agaricus bisporus and Coprinus cinereus requires introns. Fungal Genet Biol. 42: 191-9.
11. Chang ST. 2005. Ganoderma lucidum: A prominent source for the healthcare market in the 21th century. Proceedings of the first Symposium on development of China's medicinal fungi industry. pp. 15-27.
12. Chen X, Stone M, Schlagnhaufer C, Romaine CP. 2000. A fruiting body tissue method for efficient Agrobacterium-mediated transformation of Agaricus bisporus. Appl Environ Microbiol. 66:4510-3.
13. D'Souza TM, Merritt CS, Reddy CA. 1999. Lignin-modifying enzymes of the white rot basidiomycete Ganoderma lucidum. Appl Environ Microbiol. 65(12): 5307-13.
14. Haak-Frendscho M, Kino K, Sone T, Jardieu P. 1993. Ling Zhi-8: A novel T cell mitogen includes cytokine production and upregulation of ICAM-1 expression. Cell immunol. 150(1) : 101-133.
15. Hirano T, Sato T, Yaegashi K, Enei H. 2000. Efficient transformation of the edible basidiomycete Lentinus edodes with a vector using a glyceraldehyde-3-phosphate dehydrogenase promoter to hygromycin B resistance. Mol Gen Genet. 263: 1047- 52.
16. Hsu HC, Hsu CI, Lin RH, Kao CL, Lin JY. 1997. Fip-vvo, a new fungal immunomodulatory protein isolated from Volvariella volvacea. Biochem J. 323 (Pt 2) : 557-65.
17. Hsu HY, Hua KF, Lin CC, Lin CH, Hsu J, Wong CH. 2004. Extract of Reishi polysaccharides induces cytokine expression via TLR4-modulated protein kinase signaling pathways. J Immunol. 173(10): 5989-5999.
18. Janusz MJ, Austen KF, Czop JK. 1989. Isolation of a yeast heptaglucoside that inhibets monocyte phagocytosis of zymosan particles. J Immunol. 142: 959-65.
19. Kim S, Song J, Choi HT. 2004. Genetic transformation and mutant isolation in Ganoderma lucidum by restriction enzyme- mediated integration. FEMS Microbiology letters, 233: 201-4.
20. Kim HW, Kim BK. 1999. Biomedicinal triterpenoids of Ganoderma lucidum (Curt.: Fr.) P Karst. (Aphyllophoromycetideae). Intl J Med Mushrooms, 1:121-138.
21. Ko EM, Leem YE, Choi HT. 2001. Purification and characterization of laccase isozymes from the white-rot basidiomycete Ganoderma lucidum. Appl Microbiol Biotechnol. 57(1-2): 98-102.
22. Kino K, Yamashita A, Yamaoka K, Watanabe J, Tanaka S, Ko K, Tsunoo H. 1989. Isolation and characterization of a new immunomodulatory protein, Ling Zhi-8(LZ-8), form Ganiderma lucidum. J Biol Chem. 264: 472-478.
23. Kino K, Mizumoto K, Sone T, Yamaoka J, Watanabe A, Yamashita K, Yamaoka K, Ko K, Tsunoo H. 1990 . An immunomodulatory protein, Ling Zhi-8, prevents insulitis in non-obese diabetic mice. Diabetologia. 33: 713-8.
24. Ko JL, Hsu CI, Lin RH, Kao CL, Lin JY. 1995. A new fungal immunomodulatory protein, FIP-fve isolated from the edible mushroom, Flammulina velutipes and its complete amino acid sequence. Eur J Biochem. 228(2): 244-9.
25. Kubota T, Asaka Y, Miura I, Mori H. 1982. Structures of ganoderic acids A and B, two new lanostane type bitter triterpenes from Ganoderma lucidum (Fr.) Karst. Helv Chim Acta. 65: 611-619.
26. Larsson S, Cassland P, Jonsson LJ. 2001. Development of a Saccharomyces cerevisiae strain with enhanced resistance to phenolic fermentation inhibitors in lignocellulose hydrolysates by heterologous expression of laccase. Appl Environ Microbiol 67(3): 1163-70.
27. Leonowicz A, Cho NS, Luterek J, Wilkolazka A, Wojtas-Wasilewska M, Matuszewska A, Hofrichter M, Wesenberg D, Rogalski J. 2001. Fungal laccase: properties and activity on lignin. J Basic Microbiol. 41(3-4): 185-227.
28. Lei LS, Lin ZB. 1992. Effect of Ganoderma polysaccharides on T cell subpopulations and production and production of interleukin 2 in mixed lymphocyte response. Acta Pharmaceuica Sinica, 27(5): 331-5.
29. Lei LS, Lin ZB. 1991. Effect of Ganoderma polysaccharides on the activity of DNA polymerase αin spleen cells stimulated by alloantigens in mice in vitro. J Beijing Medical University 23(4): 329-33.
30. Li L, Steffens JC. 2002. Overexpression of polyphenol oxidase in transgenic tomato plants results in enhanced bacterial disease resistance. Planta 215(2): 239-47.
31.Lieu CW, Lee SS, Wang SY. 1992. The effect of Ganoderma lucidum on induction of differentiation in leulsemic U937 cells. Anticancer Res. 12(4) : 1211-5.
32. Lin YL, Liang YC, Lee SS, Chiang BL. 2005. Polysaccharide purified from Ganoderma lucidum induced activation and maturation of human monocyte-derived dendritic cells by the NF-kappaB and p38 mitogen-activated protein kinase pathways. J Leukoe Biol. 78(2): 533-43.
33. Miyasaka N, Inoue H, Totsuka T, Koike R, Kino K, Tsunoo H. 1992. An immunomodulatory protein, Ling Zhi-8, facilitates cellular interaction through modulation of adhesion molecules. Biochem Biophys Res Commun. 186(1) :385-90.
34. Mizuno T, Sakai T, Chihara G. 1995. Health foods and medicinal usages of mushrooms. Food Review International, 11 (1) : 69-81.
35. Mougin C, Boyer FD, Caminade E, Rama R. 2000. Cleavage of the diketonitrile derivative of the herbicide isoxaflutole by extracellular fungal oxidases. J Agric Food Chem. 48(10): 4529-34.
36. Servili M, De Stefano G, Piacquadio P, Sciancalepore V. 2000. A novel method for removing phenols from grape must. Am J Enol Vitic. 51: 357-361.
37. Sun L, Cai HQ, Xu WH, Hu YL, Gao Y, Lin ZP. 2001. Efficient transformation of the medicinal mushroom Ganoderma lucidum. Plant Molecular Biology Reporter, 19: 383-4.
38. van der Hem LG, van der Vliet JA, Bocken CF, Kino K, Hoitsma AJ, Tax WJ. 1995. Ling Zhi-8: studies of a new immunomodulating agent. Transplantation 60(5): 438-43.
39. Wang G, Zhang J, Mizuno T, Zhuang C, Ito H, Mayuzumi H, Okamoto H, Li J. 1993. Antitumor active polysaccharides from the Chinese mushroom Song Shan Lingzhi, the fruiting body of Ganoderma tsugae. Biosci Biotech Biochem. 57 (6): 894-900.
